影响各种化学键的强弱的主要因素
离子键
专有名词:晶格能
- 离子键两端原子的大小:距离越小,离子键越稳定
- 价电子数:越多离子键越稳定
补充:
【晶格能的概念】
在反应时 1mol 离子化合物中的阴、阳离子从相互分离的气态结合成离子晶体时所放出的能量.或破坏 1mol 晶体,使它变成完全分离的气态自由离子所需要消耗的能量.
【晶格能的影响因素】
- 离子半径:阴阳离子半径越小,离子键越强,晶格能越大,例如,随着卤离子半径增大,卤化物的晶格能降低;
- 离子电荷:离子电荷越多,离子键越强,晶格能越大;
- 电子构型:$\text{Cu}^+$ 和 $\text{Na}^+$ 半径相近、离子电荷相同,但 $\text{Cu}^+$ 是18电子构型,对阴离子会产生极化作用,因此晶格能:$\text{Cu}_2\text{S}<\text{Na}_2\text{S}$.
【晶格能的应用】
判断晶体的稳定性.晶格能越大,离子键越强,晶体越稳定.
共价键
专有名词:键长、键能、电子云重合
- 原子间的核间距(成键原子半径):越小共价键越强
- 共用电子对数:越多越强
大 $\pi$键:$\Pi_n^m$ n 原子数,m 总电子数
金属键
【基本概念】
金属键就是金属离子和自由电子之间的强烈的相互作用.存在于金属单质和合金中.成键微粒是金属阳离子和自由电子;
【影响因素】
- 金属元素的原子半径
- 单位体积内自由电子的数目
一般而言:金属元素的原子半径越小,单位体积内自由电子数目越大,金属键越强,金属晶体的硬度越大,熔、沸点越高.如:同一周期金属原子半径越来越小,单位体积内自由电子数增加,故熔点越来越高,硬度越来越大;同一主族金属原子半径越来越大,单位体积内自由电子数减少,故熔点越来越低,硬度越来越小.
对比:

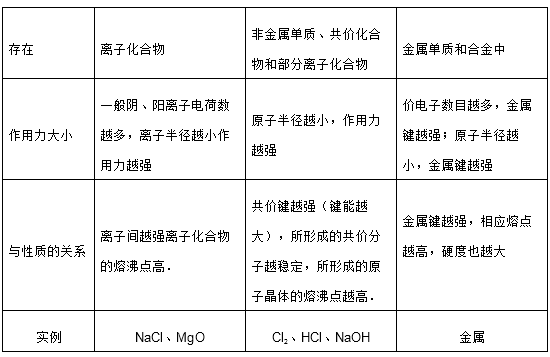
分子间作用力
范德华力
课本:一般随相对分子质量增大而增大
影响:熔点、沸点、溶解度等
氢键
- 定义:某些氢化物的分子之间存在着一种比分子间作用力稍强的相互作用,使它们只能在较高的温度下才能汽化,这种相互作用叫做氢键.常见易形成氢键的化合物:$\text{HF}$、$\text{H}_2\text{O}$、$\text{N}\text{H}_3$等.
- 特点:
①有方向性和饱和性;
②氢键的键能比化学键能小,比分子间作用力稍强.因此氢键不属于化学键,其强度比化学键弱得多,又不属于分子间力(范德华力),但它比分子间作用力稍强. - 通式:
氢键结合的情况可用X-H…Y表示.式中X和Y代表F,O,N等电负性大而原子半径较小的非金属原子.X和Y可以是两种相同的元素,也可以是两种不同的元素. - 氢键作用:
(1)增强分子间溶解度,例如:1体积水中可溶解700体积氨气.
(2)分子内氢键使物质熔沸点降低。